Graphita, formula hypothetica: C, pondus hypotheticum: 12.01, est forma carbonis elementi, unumquodque atomum carbonis cum tribus aliis atomis carbonis (in hexagonis favum mellis dispositi) ad moleculum covalentem formandum.Quia uterque atomus carbonis electronicum emittit, quae libere movere possunt, graphita est conductor.
Graphite est una e mollissimis mineralibus, et eius usus includunt faciens plumbum ducit et lubricantes.Carbon est elementum non-metallicum in secundo cyclo IVA coetus tabulae periodicae.Aliquam lacinia efficitur ante.
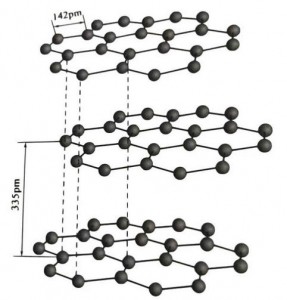
Graphite mineralis crystallinum elementorum carbonis est, eiusque cancellos cristallinus est structura sexangulae stratae.Distantia inter lavacrum cujusque reticulum est 3.35A, et spatium atomorum carbonis in eodem strato reticulum est 1.42A.Est systema crystallum hexagonale cum integra trilicium bipertitum.Fissura superficies est maxime vinculis hypotheticis, moleculis minus gratus, ideoque naturalis eius natatio valde bona est.
In crystallis graphitis, atomi carbonis in eodem lavacro nexum covalentem cum hybridizatione formant, et unumquodque carbonis atomi tribus aliis atomis in tribus vinculis covalentibus iungitur.Sex atomi carbonis efficiunt circulum sex continuum in eodem plano, in lamellae structuram protensum, ubi vinculum vinculi CC 142pm est longitudo, quae prorsus intra vinculum est longitudo cristalli atomici, ut in eodem tabulato. est crystallum atomicum.Atomis carbonis in eodem plano unam p orbitam habent, quae se mutuo includunt.Electrons sunt relative liberi, electronici in metallis liberi aequipollentes, ergo graphite calorem et electricitatem ducere possunt, quod est proprium crystallorum metalli.Sic etiam crystallis metallicis indicatur.
Medius iacus crystalli graphite per 335pm separatus est, et distantia magna est.Componitur cum vi van der Waals, hoc est, lavacrum ad crystallum hypotheticum pertinet.Attamen, quia ligatio atomorum carbonis in eodem strato plano valde munita et difficillima est ad destruendum, punctum dissolutionis graphitae etiam altissima est et eius proprietates chemicae stabilis est.
Secundum peculiarem eius compagem modum, considerari non potest ut unus crystallus vel polycrystalis, graphita vulgo nunc crystallus mixtus reputatur.
Post tempus: Iul-31-2023